¡Bienvenido a una nueva entrada! Aquí aprenderás de qué está formada la materia, los modelos atómicos, las partículas subatómicas, cómo dibujar átomos según Bohr y, por último, los elementos más usuales de la tabla periódica (en valenciano esto último).
Todo lo que encontrarás más abajo ha sido extraído de este PowerPoint que he creado en valenciano:
También puedes descargar este Word con todo el contenido resumido:
O verlo on-line para no tener que descargar nada en esta Presentación de Google:
https://docs.google.com/presentation/d/1NyOgXF8IYZQaIKTQNqTpQlDZE4Xgl2E648KVp1yr6JQ/edit?usp=sharing
https://docs.google.com/presentation/d/1nGzEUJV0CApLpOTHb0d8Jk5fVe9a3Zx5Lhl-JC9y5gI/edit?usp=sharing
1. Partículas que forman la materia
- La materia está formada por partículas muy pequeñas llamadas átomos.
- ÁTOMO en griego significa INDIVISIBLE (a + tomo = negativo + división)
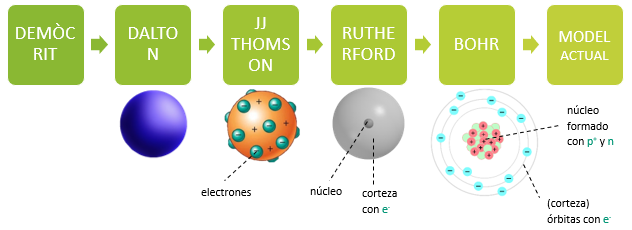
2. Modelos atómicos
- La primera idea de que la materia estaba formada por partículas indivisibles la propuso Demócrito.
- Dalton recuperó esa idea porque se ajustaba a sus datos experimentales, y propuso la siguiente idea atómica:
- Toda la materia está formada por partículas indivisibles llamadas átomos.
- Todos los átomos de un elemento químico son iguales entre sí y diferentes de los átomos de cualquier otro elemento químico.
- Un compuesto está formado por átomos de dos o más elementos que se combinan en una proporción fija.
- Más tarde, JJ Thomson descubrió el electrón (e-), una partícula más pequeña que el átomo y que proviene de dentro de este. Thomson propone un nuevo modelo:
- El átomo es una esfera de carga positiva con e- (carga negativa) incrustados.
- Rutherford (alumno de Thomson) diseñó el experimento de la lámina de oro con la finalidad de comprobar el modelo de Thomson. Los resultados no fueron satisfactorios y propuso un nuevo modelo:
- El átomo tiene un núcleo con toda la masa y alrededor tiene una corteza con e- en movimiento (primer modelo nuclear = primer modelo con núcleo).
- Bohr propuso un nuevo modelo, necesario por los avances en física:
- El átomo tiene un núcleo con protones (p+, carga positiva) y neutrones (n, sin carga). Los e- se encuentran en la corteza pero siguiendo trayectorias circulares.
- Existe un modelo más actual.
3. Modelo de Bohr: partículas subatómicas
Según Bohr, «dentro» de los átomos existen partículas más pequeñas que ellos.
- NÚCLEO:
- neutrones (n):
- son partículas neutras.
- tienen 1’7·10^-27 kg de masa.
- protones (p+):
- son partículas positivas.
- tienen 1’67·10^-27 kg de masa.
- neutrones (n):
- CORTEZA:
- electrones (e-):
- son partículas negativas.
- tienen 9’1·10^-31 kg de masa.
- electrones (e-):

- Los átomos pueden ganar o perder e-, pero nunca p+ o n. Si modificamos el núcleo de un átomo, se desprenden enormes cantidades de energía.
- Él número de protones define el elemento del átomo.
- Variar el número de neutrones correspondientes a un elemento lo convierte en inestable y se crea un isótopo.
- ISÓTOPOS: elementos con igual Z (p+) y distinto A (p+ + n) = mismos elementos con distinta cantidad de n.
- IÓN: átomos que no son neutros:
- positivo: cationes.
- negativo: aniones.
4. Modelo de Bohr: dibujar átomos
- Para dibujar el núcleo, necesitamos dos parámetros:
- A: número másico: cantidad de p+ + cantidad de n
- Z: número atómico: cantidad de p+
- Para dibujar la corteza, debemos tener en cuenta (solo podemos sumar o restar e-) :
- El átomo es neutro: e- = p+.
- El átomo es positivo: tantos p+ más que e- según la cantidad de partículas positivas más que negativas hayan.
- El átomo es negativo: tantos e- más que p+ según la cantidad de partículas negativas más que positivas hayan.
Los e- se dibujan en órbitas (se van rellenando desde la primera hasta que se coloquen todos los necesarios) :
- 1ª órbita: hasta 2 e-
- 2ª órbita: hasta 8 e-
- 3ª órbita: hasta 18 e-
5. Elementos usuales tabla periódica (en valenciano)
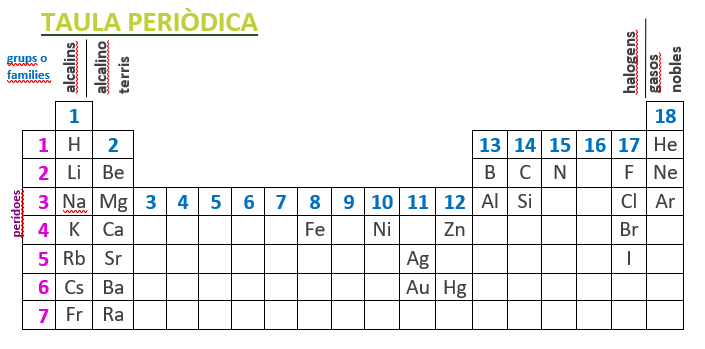
GRUPO 1: alcalins
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | H | Hidrogen |
| 2 | Li | Liti |
| 3 | Na | Sodi |
| 4 | K | Potassi |
| 5 | Rb | Rubidi |
| 6 | Ce | Cesi |
| 7 | Fr | Franci |
GRUPO 2: alcalino-terris
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | Be | Beril·li |
| 3 | Mg | Magnesi |
| 4 | Ca | Calci |
| 5 | Sr | Estronci |
| 6 | Ba | Bari |
| 7 | Ra | Radi |
GRUPO 8
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | Fe | Ferro |
| 5 | ||
| 6 | ||
| 7 |
GRUPO 10
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | Ni | Niquel |
| 5 | ||
| 6 | ||
| 7 |
GRUPO 11
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | Ag | Plata / Argeli |
| 6 | Au | Or |
| 7 |
GRUP 12
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | Zn | Zinc |
| 5 | ||
| 6 | Hg | Mercuri |
| 7 |
GRUPO 13
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | B | Bor |
| 3 | Al | Alumini |
| 4 | ||
| 5 | ||
| 6 | ||
| 7 |
GRUPO 14
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | C | Carboni |
| 3 | Si | Silici |
| 4 | ||
| 5 | ||
| 6 | ||
| 7 |
GRUPO 15
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | N | Nitrogen |
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 |
GRUPO 17
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | ||
| 2 | F | Fluor |
| 3 | Cl | Clor |
| 4 | Br | Brom |
| 5 | I | Iode |
| 6 | ||
| 7 |
GRUPO 18
| Período | Símbolo | Nombre |
|---|---|---|
| 1 | He | Heli |
| 2 | Ne | Neó |
| 3 | Ar | Argó |
| 4 | ||
| 5 | ||
| 6 | ||
| 7 |
¡Espero que te haya servido! Visita otras entradas como esta en eva-arnau.es
