El contenido de esta entrada ha sido extraído de los siguientes archivos que he creado a partir de la información que he recibido:
0. Nombres d’oxidació / valències
El nombre d’oxidació o valència és la quantitat d’electrons que s’utilitzen per combinar-se amb altres elements i formar compostos.
Representació
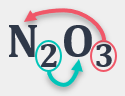
La valència/nº d’oxidació d’un element correspon amb el subíndex de l’element que l’acompanya perquè s’inverteixen.
En el cas de l’esquerra, la valència del nitrogen és 3 i de l’oxígen, 2.
A més, s’ignora el signe (positiu/negatiu) de la valència quan es representen en xifra.

Simplificació
- Sempre que es pot, les valències es simplifiquen (divideixen entre el mateix nombre).
- Hi ha que atendre si està indicada la valència de l’element conegut per saber si ha hagut simplificació, ja que és important a l’hora d’escriure la nomenclatura de stock.
En el cas de l’esquerra, com l’oxígen sempre té valència -2, sabem que ha sigut simplificat (entre 2 perquè siga 1) i per això la valència que s’indica del sofre és 3 quan realment té 6.
Nombrar prefixos
Els prefixos indiquen la valència, així que hi ha que coneixer la manera de nombrar-los abans de conèixer la nomenclatura dels compostos binaris:
- 2: di
- 3: tri
- 4: tetra
- 5: penta
- 6: hexa
- 7: hepta
1. Òxids (val. = -2)
Els òxids sempre estàn formats per un metall (m) o no metall (n) i l’oxígen:
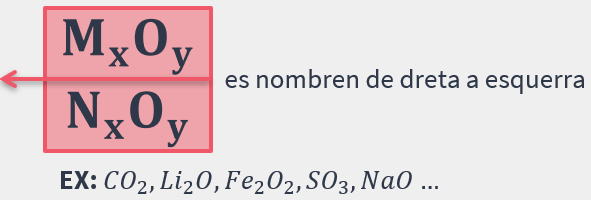
Nomenclatura de composició
Segueix la següent fòrmula: (prefix)-òxid + de + (prefix)-element.
Aquestos són alguns exemples:
- CO2: diòxid de carboni
- Li2O: òxid de diliti
- Fe2O2: diòxid de diferro
- SO3: triòxid de sofre
- NaO: òxid de sodi
Nomenclatura de stock
Segueix la següent fòrmula: òxid + de + element(*nºd’oxidació).*S’indica si té més d’un nombre d’oxidació*S’escriu sense espai entre l’element i el nombre d’oxidació
Aquestos són alguns exemples:
- CO2: òxid de carboni(IV)
- Li2O: òxid de liti
- Fe2O2: òxid de ferro(II)
- SO3: òxid de sofre(VI)
- NaO: òxid de sodi
2. Hidrurs (val. = -1)
Els hidrurs sempre estàn formats per un metall (m) i l’hidrògen o l’hidrògen i un no metall (n). Aquestos canvien l’ordre perquè en dissoldre’s amb aigua (H2O) es converten en ÀCIDS HIDRÀCIDS:
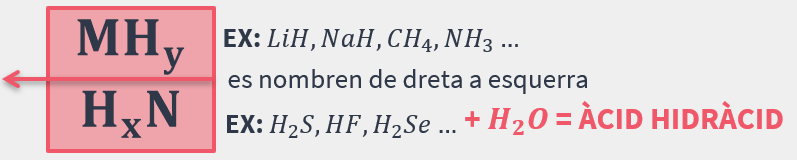
METALLS
Nomenclatura de composició
Segueix la següent fòrmula: (prefix)-hidrur + de + element.
Aquestos són alguns exemples (amb color blau la nomenclatura comú):
- LiH: hidrur de liti
- NaH: hidrur de sodi
- CH4: tetrahidrur de carboni /metà
- NH3: trihidrur de nitrògen /amoníac
- BH3: trihidrur de bor /borà
Nomenclatura de stock
Segueix la següent fòrmula: hidrur + de + element(*nºd’oxidació).*S’indica si té més d’un nombre d’oxidació*S’escriu sense espai entre l’element i el nombre d’oxidació
Aquestos són alguns exemples:
- LiH: hidrur de liti
- NaH: hidrur de sodi
- CH4: hidrur de carboni(IV)
- NH3: hidrur de nitrògen(III)
- BH3: hidrur de bor
NO METALLS
Nomenclatura de composició
Segueix la següent fòrmula: element-ur + de + (prefix)-hidrògen.
Aquestos són alguns exemples:
- HF: fluorur d’hidrògen
- HBr: bromur d’hidrògen
- H2S: sulfur d’hidrògen (en el cas del sofre, l’arrel sempre és sulf-: sulfur, sulfhídric)
- H2Se: selenur d’hidrògen
Nomenclatura tradicional
Segueix la següent fòrmula: àcid + element-hídric.
Aquestos són alguns exemples:
- HF: àcid fluorhídric
- HBr: àcid bromhídric
- H2S: àcid sulfhídric
- H2Se: àcid selenhídric
3. Sals binàries
Les sals binàries sempre es formen per un metall (m) a l’esquerra que aplica la seua valència positiva i un no metall (n) a la dreta que aplica la seua valència negativa.

Nomenclatura de composició
Segueix la següent fòrmula: (prefix)-element-ur + de + (prefix)-element.
Aquestos són alguns exemples:
- NaCl: clorur de sodi
- KCl: clorur de potassi
- NaI: iodur de sodi
- CaF2: difluorur de calci
- MgCl2: diclorur de magnesi
- FeS: sulfur de ferro
Nomenclatura de stock
Segueix la següent fòrmula: element-ur + de + element(*nºd’oxidació).*S’indica si té més d’un nombre d’oxidació*S’escriu sense espai entre l’element i el nombre d’oxidació
Aquestos són alguns exemples:
- NaCl: clorur de sodi
- KCl: clorur de potassi
- NaI: iodur de sodi
- CaF2: fluorur de calci
- MgCl2: clorur de magnesi
- FeS: sulfur de ferro(II)
4. Hidròxids (val. = -1)
Els hidròxids sempre es formen per un metall (m) i el conjunt d’oxígen i hidrògen (OH):

Nomenclatura de composició
Segueix la següent fòrmula: (prefix)-hidròxid+ de + element.
Aquestos són alguns exemples:
- NaOH: hidròxid de sodi
- Ca(OH)2: dihidròxid de calci
- Al(OH)3: trihidròxid d’alumini
- Mg(OH)2: dihidròxid de magnesi
- Fe(OH)3: trihidròxid de ferro
Nomenclatura de stock
Segueix la següent fòrmula: hidròxid + de + element(*nºd’oxidació).*S’indica si té més d’un nombre d’oxidació*S’escriu sense espai entre l’element i el nombre d’oxidació
Aquestos són alguns exemples:
- NaOH: hidròxid de sodi
- Ca(OH)2: hidròxid de calci
- Al(OH)3: hidròxid d’alumini
- Mg(OH)2: hidròxid de magnesi
- Fe(OH)3: hidròxid de ferro(III)
5. Elements a conèixer
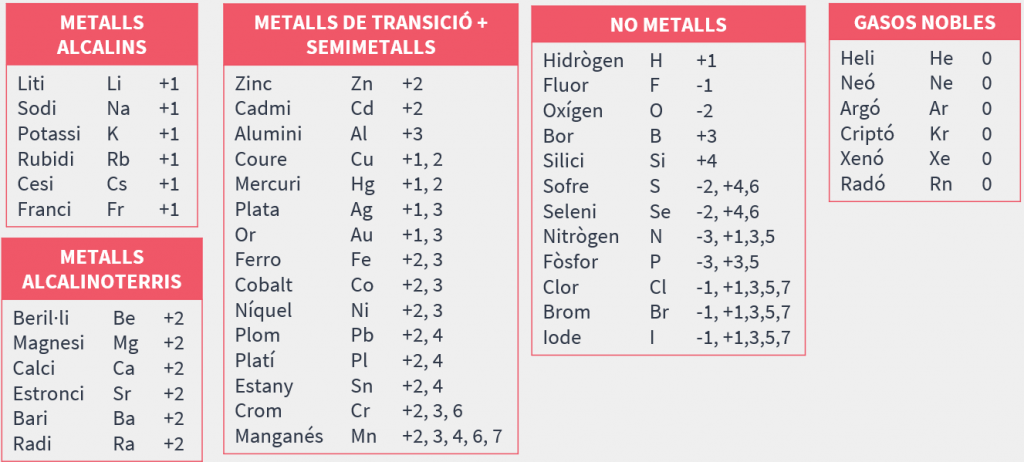
- Metalls alcalins:
- Liti Li +1
- Sodi Na +1
- Potassi K +1
- Rubidi Rb +1
- Cesi Cs +1
- Franci Fr +1
- Metalls alcalinoterris:
- Beril·li Be +2
- Magnesi Mg +2
- Calci Ca +2
- Estronci Sr +2
- Bari Ba +2
- Radi Ra +2
- Metalls de transició + semimetalls:
- Zinc Zn +2
- Cadmi Cd +2
- Alumini Al +3
- Coure Cu +1, 2
- Mercuri Hg +1, 2
- Plata Ag +1, 3
- Oro Au +1, 3
- Ferro Fe +2, 3
- Cobalt Co +2, 3
- Níquel Ni +2, 3
- Plom Pb +2, 4
- Platí Pb +2, 4
- Estany Sn +2, 4
- Crom Cr +2, 3, 6
- Manganés Mn +2, 3, 4, 6, 7
- No metalls:
- Hidrògen H +1
- Fluor F -1
- Oxígen O -2
- Bor B +3
- Silici Si +4
- Sofre S -2, +4,6
- Seleni Se -2, +4,6
- Nitrògen N -3, +1,3,5
- Fòsfor P -3, +3,5
- Clor Cl -1, +1,3,5,7
- Brom Br -1, +1,3,5,7
- Iode I -1, +1,3,5,7
- Gasos nobles:
- Heli He 0
- Neó Ne 0
- Argó Ar 0
- Criptó Kr 0
- Xenó Xe 0
- Radó Rn 0
Espere que us hagi agradat! Més entrades com aquesta en eva-arnau.es ;).
