El contingut d’aquesta entrada ha sigut extret del següent arxiu que he creat a partirr de la informació explicada a classe:
0. Introducció
Electronegativitat
L’electronegativitat és la capacitat d’atraure electrons d’un àtom quan forma part d’una molècula. Aquesta depén de la seua necessitat d’omplir la capa de valència (seguint la configuració electrònica). Així, els elements de la part superior dreta són més electronegatius que els de la part inferior esquerra.

Nombres d’oxidació dels elements
El nombre d’oxidació d’un àtom és la càrrega elèctrica que presenta després de combinar-se amb altres elements (en guanyar o perdre electrons).
Aquestos són els nombres d’oxidació dels elements més comuns:
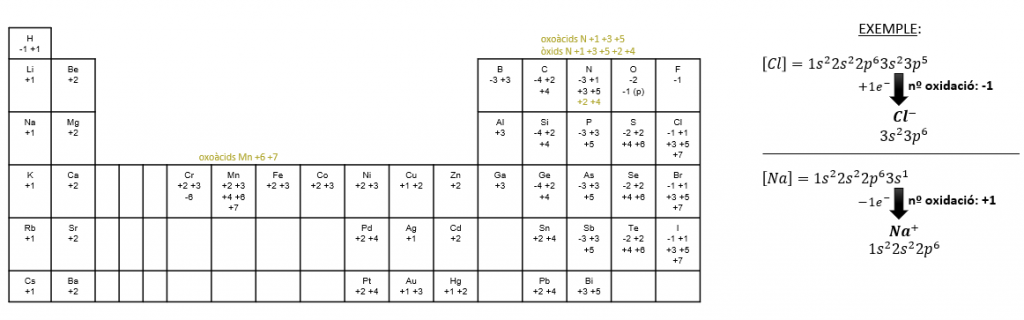
Aquestes són unes taules d’estudi amb els elements ordenats pels seus nombres d’oxidació:
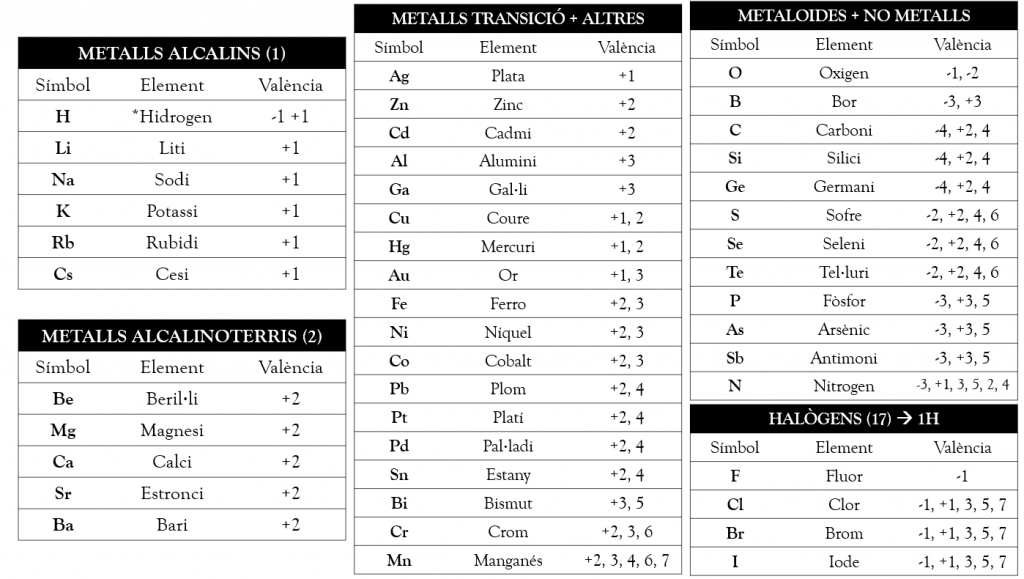
Base
Aquesta entrada es centra en la formulació inorgànica dels compostos ternaris. Per repassar els compostos binaris amb major profunditat, pots visitar aquesta entrada.
Abans de començar amb la formulació, cal tindre en compte:
- Als compostos binaris, l’element més electronegatiu se situa a la dreta i actua amb la valència negativa.
- Els prefixos numèrics es poden simplificar (dividir entre el mateix número) i són els següents:
- mono (*només s’especifica en els òxids quan l’element de l’esquerra té més d’una valència)
- di
- tri
- tetra
- penta
- hexa
- hepta
- Les arrels irregulars dels elements són les següents:
- Nitrogen Nitr-
- Sofre Sulf- (SULFUR/SULFAT/SULFIT però SULFURÓS/SULFÚRIC)
- Fòsfor Fosf- (FOSFUR/FOSFAT/FOSFIT però FOSFORÓS/FOSFÒRIC)
- Carboni Carb-
- Arsènic Arseni-
- Antimoni Antimoni-
- Seleni Seleni–
- Alguns elements tenen un nom tradicional que substitueix la seua corresponent nomenclatura de stock:
- NH3: hidrur de nitrogen(III) –> amoníac
- PH3: hidrur de fòsfor(III) –> fosfina/fosfà
- BH3: hidrur de bor –> borà
- CH4: hidrur de carboni(IV) –> metà
- SiH4: hidrur de silici(IV) –> silà
- Els següents oxoàcids no segueixen les regles (i per tant, són excepcions):
- H2CrO4: àcid cròmic
- H2Cr2O7: àcid dicròmic
- H2MnO3: àcid manganós
- H2MnO4: àcid mangànic
- HMnO4: àcid permangànic
- Cal conèixer:
- HS–: ió/anió hidrogensulfur
- Hg22+: catió dimercuri(II)
- O22-: anió peròxid
1. Hidrurs (-1)
| E1He | NOMENCLATURA COMPOSICIÓ: (p)-hidrur de element NOMENCALTURA STOCK: hidrur d’element(*n.ox) |
| HeE1 | NOMENCLATURA COMPOSICIÓ: element-ur de (p)-hidrogen DISSOLUCIÓ AQUOSA: àcid element-hídric |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Dissolució aquosa |
|---|---|---|
| CoH3 | trihidrur de cobalt | hidrur de cobalt(III) |
| SnH4 | tetrahidrur d’estany | hidrur d’estany(IV) |
| H2S | sulfur de dihidrogen | àcid sulfhídric |
2. Òxids (-2)
| E2Oe | NOMENCLATURA COMPOSICIÓ: (p)-òxid de (p)-element NOMENCALTURA STOCK: òxid d’element(*n.ox) |
| OeE2 | NOMENCLATURA COMPOSICIÓ: (p)-element-ur de (p)-oxigen |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock |
|---|---|---|
| CuO | òxid de coure | òxid de coure(II) |
| Fe2O3 | triòxid de diferro | òxid de ferro(III) |
| SO2 | diòxid de sofre | òxid de sofre(IV) |
*SO2 és realment S2O4, però s’ha simplificat
3. Peròxids (-1 –> -2)
Els oxígens es troben agrupats en parells (O2), cadascun actua amb valència -1, així que en conjunt tenen valència -2. Aquesta parella d’oxigens no es pot simplificar perquè el prefix és necessari.
| E2(O2)e | NOMENCLATURA COMPOSICIÓ: (p)-òxid de (p)-element NOMENCALTURA STOCK: peròxid d’element(*n.ox) |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| H2O2 | diòxid de dihidrogen | peròxid d’hidrogen = aigua oxigenada |
| Cu2O2 | diòxid de dicoure | peròxid de coure(I) |
| CaO2 | diòxid de calci | peròxid de calci |
*Cu2O2 és en realitat Cu2(O2)1
*CaO2 és en realitat Ca2(O2)2
4. Sals binàries
| SbBs | NOMENCLATURA COMPOSICIÓ: (p)-element-ur de (p)-element NOMENCALTURA STOCK: element-ur de element(*n.ox) |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| PbSe2 | diseleniur de plom | seleniur de plom(IV) |
| Au2S | sulfur de dior | sulfur d’or(I) |
| ZnI2 | diiodur de zinc | iodur de zinc |
5. Hidròxids (-1)
Els hidròxids són el grup (OH) que actuen amb valència -1 (-2 de l’oxigen i +1 de l’hidrogen).
| E1(OH)e | NOMENCLATURA COMPOSICIÓ: (p)-hidròxid d’element NOMENCALTURA STOCK: hidròxid d’element(*n.ox) |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| Pt(OH)2 | dihidròxid de platí | hidròxid de platí(II) |
| KOH | hidròxid de potassi | hidròxid de potassi |
| Be(OH)2 | dihidròxid de beril·li | hidròxid de beril·li |
6. Oxoàcids
| HhEeOo | NOMENCLATURA COMPOSICIÓ: (p)-hidrogen[(p)-oxid-(p)-element-at] NOMENCALTURA STOCK: àcid (p)-element-(s) |
L’àcid (p)-element-(s) es forma segons la següent tabla tenint en compte quina valència utilitza l’element(E):
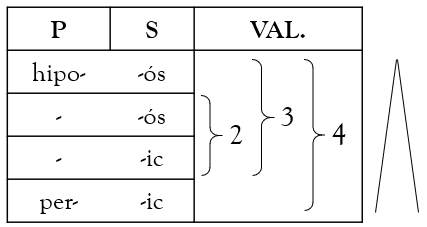
Per conèixer la valència que utilitza l’element(E), s’ha de sumar la valència de l’hidrogen (+1) i de l’oxigen (-2) amb la de l’element i que el resultat siga 0 (ja que no té càrrega).
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| H2SO4 | dihidrogen(tetraoxidsulfat) | àcid sulfúric |
| H3PO3 | trihidrogen(trioxidfosfat) | àcid fosforós |
| HClO | hidrogen(oxidclorat) | àcid hipoclorós |
*En H3PO3, l’hidrogen té valència +1·3 i l’oxígen -2·3, de manera que la valència del fòsfor és |3 – 6| = 3. Com té valències +3, 5, utilitza -ós
*En HClO, l’hidrogen té valència +1 i l’oxígen -2, de manera que la valència del clor és |1 – 2| = 1. Com té valències +1, 3, 5, 7- utilitza hipo- -ós
7. Oxisals
| c | NOMENCLATURA COMPOSICIÓ: (p)-oxid-(p)-elementE-at de (p)-elementM NOMENCALTURA STOCK: àcid (p)-element-(s) –> (p)-elementE-(s2) de elementM(*n.ox) |
| Mp(EeOo)m | NOMENCLATURA COMPOSICIÓ: (p2)-[(p)-oxid-(p)-elementE-at] de (p)-elementM NOMENCALTURA STOCK: = |
A tenir en compte:
- Prefixos 2 (P2):
- –
- bis
- tris
- tetrakis
- pentakis
- Sufixos 2 (S2): a partir del sufix de l’àcid (p)-element-(s), es canvia per un altre:
- si acaba en -ós –> nou sufix -it
- si acaba en -it –> nou sufix -at
- En fer el canvi de l’oxoàcid a l’oxisal (per conèixer l’àcid), el subíndex de l’hidrogen es manté en el metall perquè indica la valència de la part que es manté; en canvi, el subíndex del parèntesi amb el metall no es manté amb el hidrogen perquè indica la valència del metall (que s’ha substituit per l’hidrogen, amb valència +1): Co3(PO4)2 –> H3PO4.
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| Ag3PO4 | tetraòxidfosfat de triplata | fosfat de plata |
| Co3(PO4)2 | bis(tetraoxidfosfat) de tricobalt | fosfat de cobalt(III) |
| LiBrO3 | trioxidbromat de liti | bromat de liti |
| Be(NO2)2 | bis(dioxidnitrat)) de beril·li | nitrit de beril·li |
*L’àcid del que prové Co3(PO4)2 és H3PO4 –> àcid fosfòric
*L’àcid del que prové LiBrO3 és HBrO3 –> àcid bròmic
*L’àcid del que prové Be(NO2)2 és HNO2 –> àcid nitrós
8. Sals àcides
Amb oxigen
| MmHhEeOo | NOMENCLATURA COMPOSICIÓ: (p)-hidrogen-[(p)-oxid-(p)-elementE-at] de (p)-elementM NOMENCALTURA STOCK: àcid (p)-element-(s) –> (p)-hidrogen-(p)-element-(s) de elementM(*n.ox) |
| Mp(HhEeOo)m | NOMENCLATURA COMPOSICIÓ: (p2)-[(p)-hidrogen-(p)-oxid-(p)-elementE-at] de (p)-elementM NOMENCALTURA STOCK: = |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| AuH2PO3 | dihidrogen(trioxidfosfat)) d’or | dihidrogenfosfit d’or(III) |
| Mg(HCO3)2 | bis(hidrogentrioxidcarbonat) de magnesi | hidrogencarbonat de magnesi |
| AgHCr2O7 | hidrogen(heptaoxiddicromat) de plata | hidrogendicromat de plata |
| Fe(HSO3)3 | tris(hidrogentrioxidsulfat) de ferro | hidrogensulfit de ferro(III) |
*L’àcid del que prové Mg(HCO3)2 és H2CO3 –> àcid carbònic
*L’àcid del que prové AgHCr2O7 ésH2Cr2O7–> àcid dicròmic
*L’àcid del que prové Fe(HSO3)3 és H2SO3 –> àcid sulfós
Sense oxigen
| MmHhEe Mp(HhEe)m | NOMENCALTURA STOCK: hidrogen-elementE-ur de elementM(*n.ox) |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| Fe(HS)3 | – | hidrogensulfur de ferro(III) |
| Cu(HS)2 | – | hidrogensulfur de coure(II) |
9. Ions
Ió amoni
L’ió amoni NH4+ té una càrrega positiva.
| (NH4)eE | NOMENCLATURA COMPOSICIÓ: arrel de (p)-amoni NOMENCALTURA STOCK: arrel d’amoni |
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| (NH4)2S | sulfur de diamoni | sulfur d’amoni |
| NH4OH | hidròxid d’amoni | hidròxid d’amoni |
Ions monoatòmics
| E+ | NOMENCALTURA STOCK: ió/catió element(*n.ox) |
| E– | NOMENCALTURA STOCK: ió/anió element-ur |
*el n.ox de anió (E–) és la seua única càrrega negativa
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| Fe3+ | – | ió/catió ferro(III) |
| C4– | – | ió/anió carbur |
| Cd2+ | – | ió/catió cadmi |
Ions oxoanions
Són oxoàcids (HhEeOo) que perden total o parcialment els hidrogens i per tant adquireixen càrrega negativa.
| EeOo– | NOMENCALTURA COMPOSICIÓ: ió/anió (p)-oxid-(p)-element-at(càrrega-) NOMENCLATURA STOCK: àcid (p)-element-(s) –> ió/anió (p)-element-(s2) |
| HhEeOo– | NOMENCALTURA COMPOSICIÓ: ió/anió (p)-hidrogen[-(p)-oxid-(p)-element-at](càrrega-) NOMENCLATURA STOCK: àcid (p)-element-(s) –> ió/anió (p)hidrogen-(p)-element-(s2) |
*Els oxoanions HhEeOo– formen sals àcides (MmHhEeOo)
EXEMPLES:
| Fórmula | Nomenclatura composició | Nomenclatura stock / Nom. tradicional |
|---|---|---|
| ClO3– | ió/anió triòxidclorat(1-) | ió/anió clorat |
| H2PO4– | ió/anió dihidrogen(tetraoxidfosfat)(1-) | ió/anió dihidrogenfosfat |
| HCO3– | ió/anió hidrogen(trioxidcarbonat)(1-) | ió/anió hidrogencarbonat |
| BrO2– | ió/anió diòxidbromat(1-) | ió/anió bromit |
*L’àcid del que prové H2PO4– és H3PO4––> àcid fosfòric
*L’àcid del que prové HCO3– és H2CO3 –> àcid carbònic
*L’àcid del que prové BrO2– és HBrO2 –> àcid bromós
Espere que t’hagi agradat! Més entrades com aquesta en eva-arnau.es ;).
