1. EVOLUCIÓ DELS MODELS ATÒMICS
Durant l’Antiga Grècia es pensava que tota la matèria es formava per la unió de quatre elements units en diferents proporcions: foc, aigua, terra i aire, anomenat TEORIA DELS QUATRE ELEMENTS.

Més endavant (s.V a.C), un filòsof conegut com Demòcrit va proposar que la matèria es formava per unes partícules xicotetes indivisibles (és a dir, que no es podien dividir en més partícules, per tant era la menor part de la matèria ja que no es formaven per res més) que va anomenar ÀTOMS en conseqüència a la seua definició [in (a) + divisibles (tom)].
Aquesta proposta no va ser molt considerada fins que John Dalton (principi s.XIX) va retomar la idea de Demòcrit de que la matèria estava formada per partícules indivisibles xicotetes. A això, va afegir que els compostos es formaven amb una combinació d’àtoms.
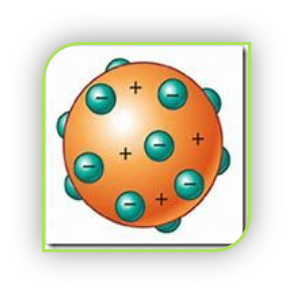
Tanmateix, Joseph John Thomson va descobrir mitjançant el seu experiment dels rajos catòdics que aquestes partícules, els àtoms, estaven formats al mateix temps per altres partícules de menor tamany que ells, per tant els àtoms ja no eren partícules indivisibles (es podien dividir en les anomenades partícules subatòmiques o quarks). La partícula subatòmica que va descobrir és l’electró. Però com ja sabien que els àtoms són neutres, això suposava que hi hagueren més partícules subatòmiques positives per contrarestar aquesta càrrega negativa dels electrons. Així va proposar el seu model del PASTÍS DE PANSES, que deia que l’àtom és una esfera o núvol de càrrega positiva amb els electrons (càrrega negativa) incrustats (com les panses a un pastís de panses) compensant la seua càrrega i sent així neutre.
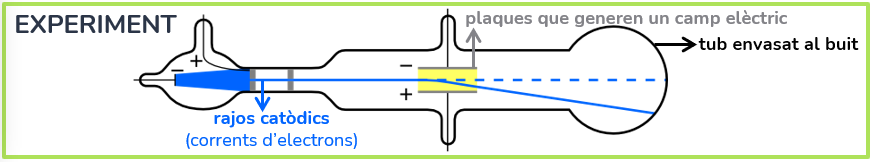
El seu experiment es tractava de disparar uns rajos catòdics a partir d’uns materials als quals «restaven» la càrrega positiva, obtenint una corrent de càrrega negativa formada per electrons (tot i que encara no ho sabien). Aquests rajos pasaven a través d’un tub envasat al buit (que permitia observar-los) dins del qual es trobaven dos plaques col·locades paralel·lament una amb camp elèctric negatiu i l’altra positiu. Canviant els materials i també la posició de les plaques, els rajos es desviaven cap a la placa carregada negativament, i en mesurar els rajos va obtindre que estaven formades per partícules de molt menor tamany que els àtoms. Per tant, va concloure que tota la matèria (ja que qualsevol matèria donava els mateixos resultats) es formava per àtoms que eren un núvol de massa amb càrrega positiva amb electrons (càrrega negativa) incrustats.
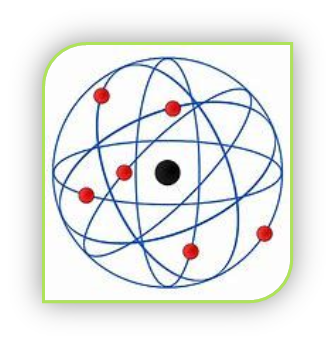
Anys després, l’alumne de Thomson, Edward Rutherford va ser qui, mitjançant el seu experiment de la llàmina d’or, va actualitzar el model del seu mestre al MODEL PLANETARI, que prén aquest nom ja que la disposició dels electrons i el nucli atòmic que va descobrir imita al model dels planetes al voltant del Sol. Va descobrir el protó com a partícula subatòmica de càrrega positiva, precissament l’encarregada de compensar la càrrega dels electrons. A més, la seua massa es concentrava en un nucli (i no en tota l’esfera de l’àtom, segons deia Thomson) al voltant del qual giraven els electrons, amb massa menyspreable (és a dir, com si no en tinguera). No obstant, aquest model ja sabia que no complia la teoria electromagnètica: els electrons desprenen energia durant el seu moviment, que finalment causaria que xocaren amb el nucli (i això mai ocurria).
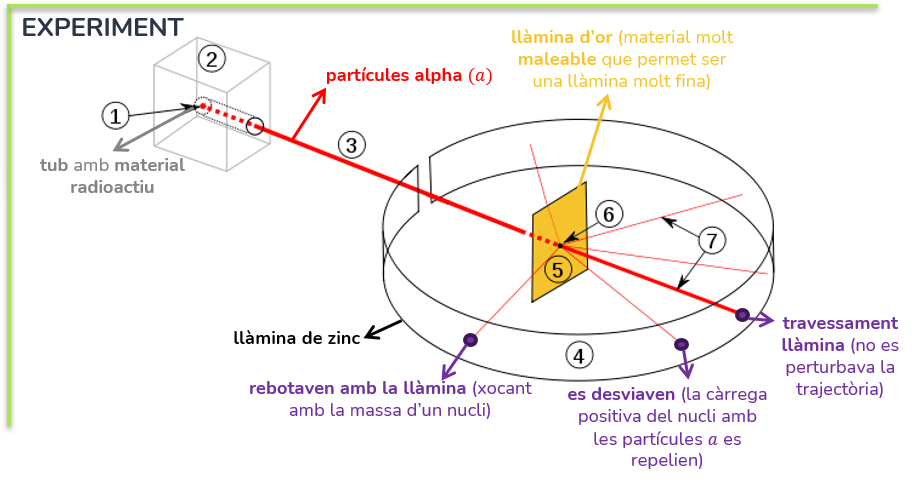
El seu experiment de la llàmina d’or es va basar en un material radioactiu que disparava partícules alpha (amb càrrega positiva) que teòricament (segons el model de Thomson) impactarien amb una llàmina d’or col·locada en frent (va escollir aquest material perquè és molt maleable, per tant permet cortar una llàmina molt fina). Al voltant d’aquesta hi havia una llàmina de zinc per recibir l’impacte d’aquestes partícules que travessaven la llàmina i comprovar la seua trajectòria.
Al contrari del que esperaven trobar, va ocòrrer que algunes partícules es desviaven i altres directament rebotaven amb la llàmina. Així que va concloure que els àtoms es formaven per un nucli atòmic on es concentrava tota la massa i estava format pels protons, per això algunes partícules rebotaven, ja que xocaven amb aquest i altres es desviaven perquè passaven molt a prop (mateixa càrrega es repel·leixen). Els electrons es troben, doncs, disposats en l’escorça i girant segons unes òrbites al voltant del nucli, amb una massa menyspreable i formant l’àtom en sí mateix.
Per solucionar el problema del model de Rutherford va arribar Bohr, que va establèixer que els electrons «salten» d’una òrbita a una altra variant el seu nivell d’energia, ja que cadascuna d’aquestes soporta una quantitat. Així, amb major proximitat al nucli, menor energia soporten les òrbites (inversament proporcional), per això els electrons: desprenen energia per saltar d’una capa externa a interna i obtenen energia per saltar d’una capa interna a una externa.
Per últim, arribem al MODEL MECANOQUÀNTIC que és el que coneixem actualment. Està basat en la mecànica quàntica i es basa en la probabilitat de trobar electrons en diferents zones de l’escorça anomenades orbitals, ja que no es pot saber amb total precissió en qualsevol moment.
Va ser construït per teories de diferents científics: Schödinger, De Broglie i Heisenberg entre altres. Els passos que es van seguir fins arribar a aquesta idea són els següents:
- Pensaven que els electrons seguien unes òrbites al voltant del nucli (formant l’escorça).
- Es van adonar que no es pot conèixer l’ubicació exacta de l’electró.
- Actualment, es pot calcular una zona on és probable trobar un electró, segons estudiarem a continuació.
2. ÀTOMS, IONS I ISÒTOPS
L’àtom
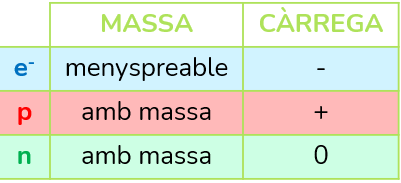
Com el coneixem actualment, l’àtom es forma per un nucli on es concentra la massa amb protons (partícules de càrrega positiva i amb massa) i neutrons (partícules sense càrrega i amb massa); i per una escorça on els electrons (partícules de càrrega negativa i amb massa menyspreable, vol dir com si no en tinguera) giren al voltant d’unes òrbites imaginàries.

Representació d’àtoms
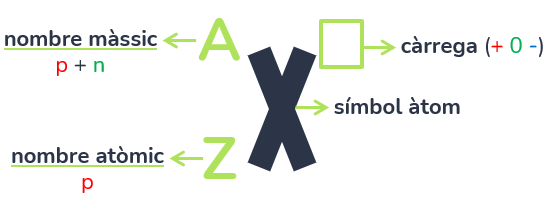
Un àtom es representa amb el seu símbol segons la taula periòdica (la X) i tal com s’indica en la imatge, en les cantonades de l’esquerra s’indicarà el nombre màssic (A) que correspón amb la suma dels protons i neutrons de l’àtom; i el nombre atòmic (Z), que correspón amb el nombre exacte de protons. A l’esquerda de dalt a la dreta s’especificarà la càrrega d’eixe àtom: positiva, neutra (no s’indicarà res) o negativa.
CÀLCUL DE PARTÍCULES
Tota aquesta informació ens serveix per conèixer com és l’àtom, a més de poder calcular totes les partícules que conté (tant al nucli com a l’escorça). Això es fa de la següent manera:
- Per conèixer el nº de protons, simplement hi ha que conèixer el nombre atòmic.
- Per conèixer el nº de neutrons, hi ha que restar el nombre atòmic (protons) al nombre màssic (protons + neutrons).
- Per conèixer el nº d’electrons, és necessari conèixer el nº de partícules positives (protons) i la càrrega (+nºprotons-nºelectrons). Com explicarem més endavant, el nucli no varia, per això la càrrega depén directament de la variació d’electrons: si es positiva, voldrà dir que ha perdut electrons per tindre menys que protons; si és negativa, vol dir que ha guanyat electrons per tindre més que protons. La quantitat d’electrons que es guanyen o es perden depenen de la càrrega: pot ser 2+ (en aquest cas haurà perdut 2 electrons perquè hi hagi 2 protons més) o per exemple 5- (en aquest cas ha guanyat 5 electrons perquè hi hagi 5 protons menys).
Ions
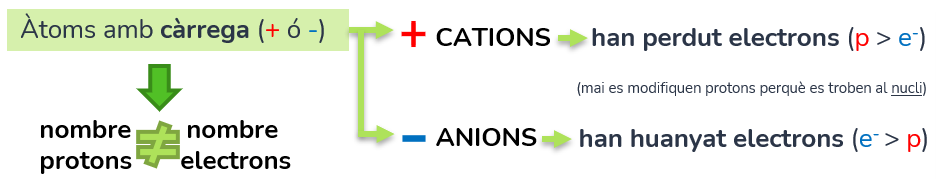
Els ions són els àtoms amb càrrega (positiva o negativa, ja que 0 és no tindre càrrega), per tant tenen una diferència en el nombre de protons i electrons.
Poden ser
–CATIONS (positiu): l’àtom ha perdut electrons (p > e-)
–ANIONS (negatiu): l’àtom ha guanyat electrons (e- > p)
En qualsevol cas no es modifica el nucli atòmic, sinó que varia el nombre d’electrons, com ja hem adelantat anteriorment.
Per conèixer la càrrega d’un àtom, simplement serà necessari +nºprotons-nºelectrons. Si el resultat és positiu, eixa és la càrrega positiva de l’àtom; si és negatiu, eixa és la càrrega negativa de l’àtom.
Isòtops
ATENCIÓ: pel moment parlarem d’isòtops neutres, sene cap càrrega per no confondre.
Els isótops són àtoms del mateix element però diferent nombre de neutrons (mateix Z i diferent A).
Relació neutrons-protons
- Els àtoms solen tindre un nombre similar de protons i neutrons entre si (partícules nuclears).
- Si la diferència és molt gran, s’obté un àtom inestable.
- Els àtoms inestables emeten radiació per tornar a ser estables.
Aplicacions dels isòtops
Els humans hem aprofitat els isòtops aplicant-los en alguns casos com:
- DATACIÓ DE MOSTRES ARQUEOLÒGIQUES: els éssers vius tenim una quantitat de C14 al cos, un isòtop inestable. Al analitzar un cos mort, un mètode molt comú per conèixer el temps que ha passat des que va perdre la vida és fixar-se en la quantiat d’aquest isòtop restant, ja que amb el pas del temps, com va emitint radiació per tornar a ser estable, es converten en la versió estable d’aquest àtom i per tant disminueix la quantitat de C14 al cos.
- COMBUSTIBLE EN CENTRALS NUCLEARS (urani, plutó): genera residus radioactius.
- MEDICINA: diagnòstic i tractament de malalties (radioterapia, TAC…).
- INVESTIGACIÓ.
3. MASSA ATÒMICA I MOLECULAR
Massa atòmica (Mat)
La massa atòmica es calcula a partir d’una mitjana de tots els isòtops (la masa de cadascun és el seu nombre màssic) presents en la natura (mateix nºprotons, diferent nºneutrons per tant diferent massa) mitjançant la següent fòrmula:

Unitat de mesura de masses atòmiques i moleculars
Per mesurar masses tan xicotetes, s’empra l’unitat de mesura dels àtoms (exclusiva per àtoms i molècules) abreviada com u [uma].
Massa molecular
- Conèixer els àtoms que formen la molècula, delimitats per cada majúscula que representa el símbol d’un àtom distint.
- Sumar les masses atòmiques (i multiplicar per quants àtoms de cada tipus hi ha).
4. CONFIGURACIÓ ELECTRÒNICA
La configuració electrònica és la manera en que es distribueixen els electrons d’un àtom en els orbitals/subnivells segons l’energia agrupats en capes/nivells.
Hi ha:
–18 orbitals que coincideixen amb cadascun dels grup de la taula periòdica.
Poden ser de 4 tipus diferents segons els electrons que hi poden haver:
·orbital s: fins 2 electrons
·orbital p: fins 6 electrons
·orbital d: fins 10 electrons
·orbital f: fins 14 electrons
–7 nivells que coincideixen amb cadacun dels períodes de la taula periòdica.
Relació configuració electrònica i taula periòdica
La configuració electrònica està relacionada amb l’ubicació dels elements a la taula periòdica perquè d’aquesta disposició dels electrons depén les propietats d’un element, concretament de la terminació d’aquesta configuració.
Diagrama de Moeller
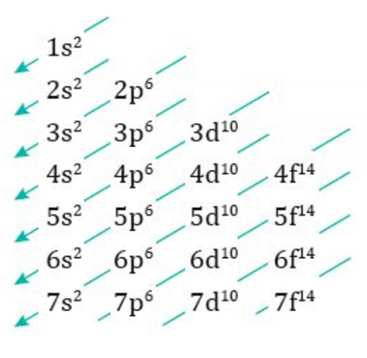
El diagrama de Moeller s’utilitza per conèixer l’ordre que segueixen els electrons per distribuir-se en els orbitals segons el seu nivell d’energia.
Electrons de valència
Tots els electrons col·locats a la capa més externa (capa de valència) són els electrons de valència, encarregats d’establèixer el comportament químic de l’element.
5. TAULA PERIÒDICA
Els elements de la taula periodica s’organitzen pel seu nombre atòmic creixent i la terminació de la configuració electrònica (l’última capa estableix el grup i l’últim orbital estableix el període) de la qual depén les propietats de l’element (i no té res a vore amb el nombre d’electrons de valència, ja que aquestos són els col·locats a la capa més externa, i en aquest cas els últims col·locats no tenen perquè ser els de la capa més externa ja que depén del diagrama de Moeller).
Va ser establit per Dmitri Mendeléyev.
A la taula periòdica hi ha alguns grups separats per raons estètiques, ja que la taula periòdica no encaixaria en cap imatge clarament. A més, els elements escrits amb un contorn en la lletra són artificials, vol dir que han sigut creats al laboratori i per tant no es troben en la natura.
Ubicació dels elements a la taula periòdica
Com ja hem dit, una manera és coneixent el seu nombre atòmic (quantitat de protons) ja que està de forma creixent (menor a major).
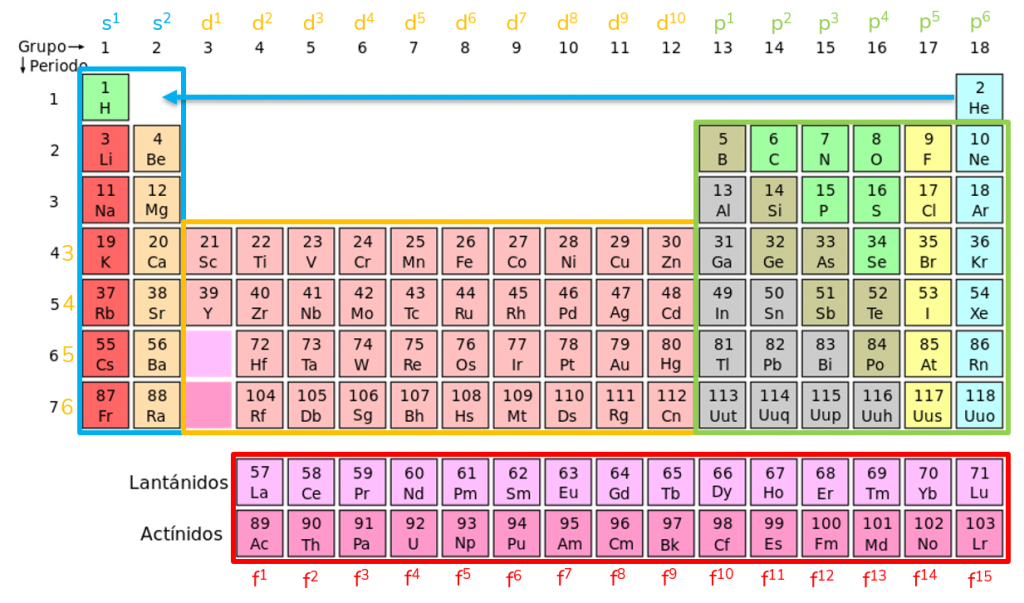
Però la terminació de la configuració electrònica (últim orbital i capa omplits) també permeten conèixer el grup i el període a partir d’aquesta imatge:
Nom dels grups
Com ja hem dit, la terminació de la configuració electrònica (últims electrons col·locats) estableix les propietats de l’element i per això apareix segons el grup i el període a la taula períodica. Així, tots els elements que pertanyen al mateix grup tenen el mateix nombre d’últims electrons col·locats al mateix orbital i coincideixen en propietats; i els que pertanyen al mateix període tenen els últims electrons col·locats a la mateixa capa.
Per això, els grups reben nom en relació a les seues propietats comuns:
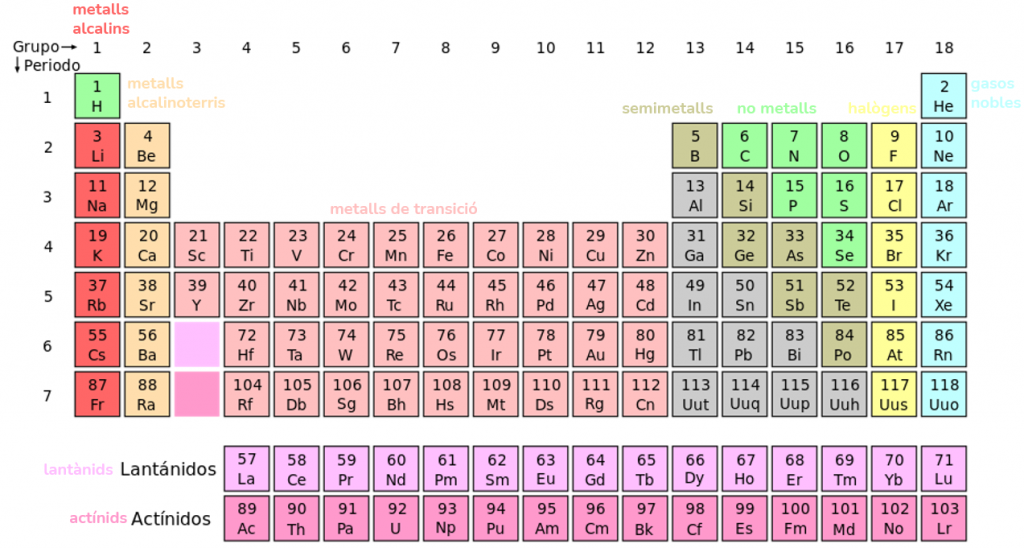
Espere que t’hagi agradat! Més entrades com aquesta en eva-arnau.es ;).
